

溶性微粒(英文名:Sub-visible Particle/Particulate matter)与可见异物(Visible Particle)相对应,意指不溶于水或有机溶剂,非代谢性的,肉眼所看不见的颗粒物。在一些注射剂应用中,要尽可能避免不溶性微粒。对微粒的微观大小的测量和分析,一直是应用中的难题。本文试图从粒径分析(粒度分布)的技术测量手段入手,对注射剂的粒度评价手段做一些探讨。
什么是不溶性微粒(不可见异物)
不溶性微粒(英文名:Sub-visible Particle/Particulate matter)与可见异物(Visible Particle)相对应,意指不溶于水或有机溶剂,非代谢性的,肉眼所看不见的颗粒物。一般指的是粒径<50μm的微粒。
我们平时生活中常见的概念就是PM2.5 PM10,意指小于等于2.5μm和10μm的悬浮于空气中的污染物。
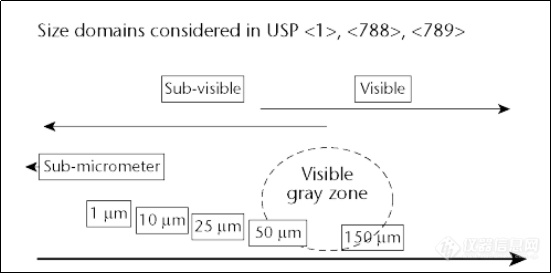
图一:可见异物VS 不可见异物范围
图一摘自美国药典
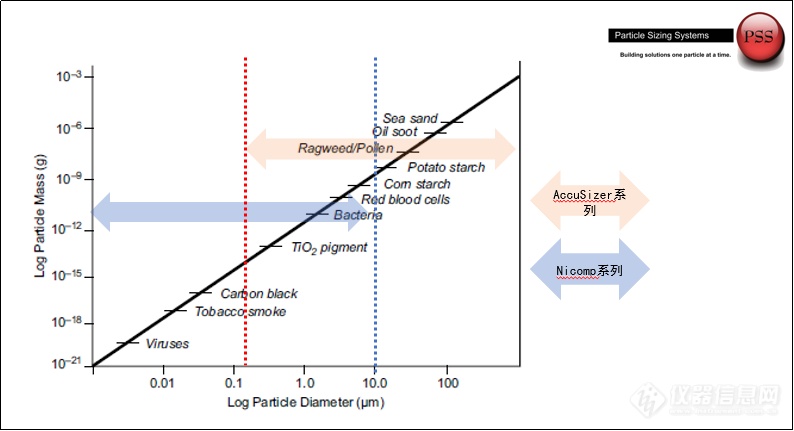
图二:PSS仪器的检测范围和不同颗粒的粒径大小
不溶性微粒(不可见异物)的来源
外源性:主要包括生产过程中各类包装容器粘附的各种微粒,如尘埃,玻璃屑,有机物,无机盐等;还包括生产设备长期磨损,相互摩擦撞击造成的脱落微粒等。
内源性:主要包括生产原料以及生产工艺的操作中所产生的不溶性微粒,如在使用注射剂等治疗疾病的过程中,治疗药物间以及治疗药物与输入药液间的理化变化所产生的不溶性微粒。
注射剂中不溶性微粒(不可见异物)的危害
含有大量不溶性微粒的输液进入人体可直接造成体温升高,心跳加快,更甚可导致休克。这是由不溶性微粒在身体某部位叠加堆积造成。主要症状有:血管阻塞,刺激发炎,肉芽肿,血液凝结等。现今各国药典均把注射剂中的不溶性微粒检查作为必检项目之一,随着检查要求越发严格,FDA近期望企业能检测的下限下探至2μm。
不溶性微粒(不可见异物)药典历史
1977年 《中国药典》规定使用目视灯检法对注射液的澄明度检查,此法无法检测小粒子。
1985年 《中国药典》规定注射液微粒限度,方法使用的是显微计数法检测不可见微粒
1995年-2000年 《中国药典》在检查方法上增加了光阻法为第二法
2005年 将原《澄明度检査细则和判断标准》修订为“可见异物检查法"并将光阻法变成了一法
2015年 《中国药典》2015年版为现行版本,基本与《美国药典》中注射剂不溶性微粒检测要求基本一致。
对于不溶性微粒(不可见异物)中国药典和美国药典的区别
虽然中国药典和USP及其他药典的检测标准基本一致,但是也有一些细微差别。
表一:CP和USP在颗粒浓度规定一览
国家 | 类别 | 一:光阻法 | 二:显微镜法 | 分辨率标准 | ||
≥10μm | ≥25μm | ≥10μm | ≥25μm | |||
中国药典 | 大容量注射剂(≥ 100 mL) | ≤ 25 粒 /mL | ≤ 3 粒 /mL | ≤ 12 粒 /mL | ≤ 2 粒 /mL | 分辨率采用中国标准 |
小容量注射剂 (< 100 mL) | ≤ 6000 粒 / 每容器 | ≤ 600 粒 / 每容器 | ≤ 3000 粒 / 每容器 | ≤ 300 粒 / 每容器 | ||
USP41-NF36 | 大容量注射剂 (> 100 mL) | ≤ 25 粒 /mL | ≤ 3 粒 /mL | ≤ 12 粒 /mL | ≤ 2 粒 /mL | 分辨率与ISO标准一致
|
小容量注射剂 (≤ 100 mL) | ≤ 6000 粒 / 每容器 | ≤ 600 粒 / 每容器 | ≤ 3000 粒 / 每容器 | ≤ 300 粒 / 每容器 | ||
美国药典1788章节介绍
1)体积确认(SAMPLE VOLUME ACCURACY)
2)流速校准(SAMPLE FOLOW RATE)
3)校准确认(CALIBRATION)
4)分辨率确认(SENSOR RESOLUTION)。
不溶性微粒(不可见异物)小知识
成人的毛细血管内径仅 4 ~ 7μm,婴幼儿的毛细血管则更细。只有粒径小于2μm的微粒才可能通过肾交换被排出体外,直径超过毛细血管内径的微粒则无法排出。较大的微粒可造成局部循环障碍,粒径为2~10 μm 的微粒则可能造成潜伏性的危害。
所以,FDA新EXPECTATION如下图:


图三:FDA期望检测2-10μm间的粒子 图四:FDA期望0.2μm上下的粒度信息
不溶性微粒(不可见异物)的整套解决方案
AccuSizer 780 A2000作为美国PSS粒度仪AccuSizer系列的明星产品,其512个数据通道和32个自定义通道,不仅满足了CP2015, USP787,USP788,USP789等现有各国药典,其多通道的优势更符合未来发展的趋势。其21CFR Part11法规软件符合cGMP要求,含审计追踪及电子签名等功能,不仅可以直接给出各国药典标准报告并且判断是否符合标准,也可自定义报告模板,适应不同的检测需求。后加小容量检测报告,大容量检测报告。
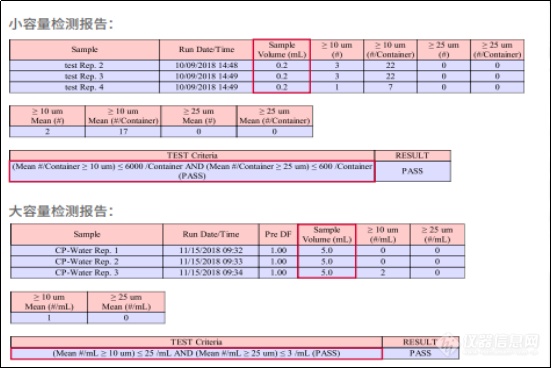
图五:PSS软件出具的不溶性微粒检测报告
PSS激光粒度仪介绍
AccuSizer780 A2000系列不溶性微粒检测仪采用单颗粒光学传感技术(Single Particle Optical Sizing)实现了对分散体系中的不溶性微粒量化计数。其对于微米级大小的颗粒的粒度表征在精确度以及准确性上有划时代的意义。美国PSS粒度仪公司的SPOS技术更是结合了光阻效应和光散理论,将颗粒计数的下限下探到0.15μm(150nm)。
这不仅迎合了更严苛的质量要求,也助力于精密制造对环境杂质的高标要求。
传统的光散射法如激光衍射法,动态光散射法在粒度表征中仅能统计出粒径累积分布,也即D10,D50,D90等数值。其优点在于无需校准,易于检测。但对少数粒子的灵敏性不足,具体表现为检测不出少数粒子的存在,且其数据来源于数学算法,往往会成为假性数据峰。SPOS技术原理图:

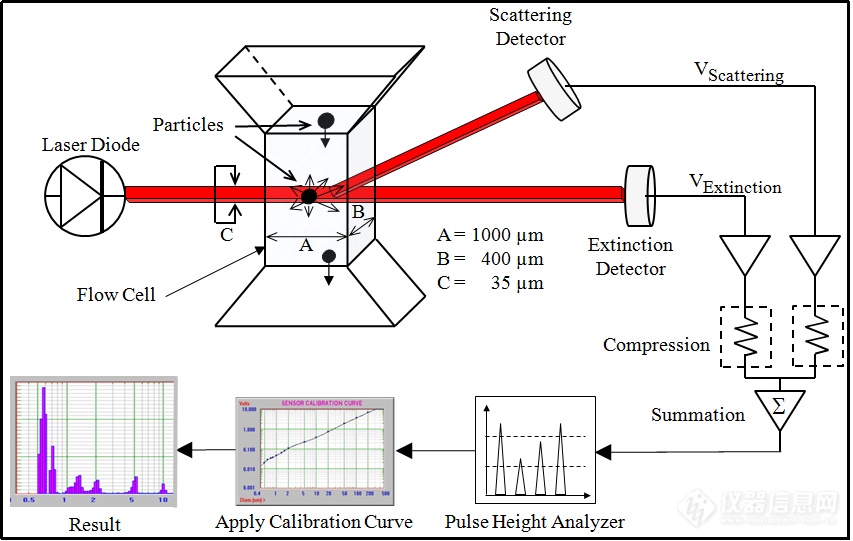
图六:PSS的SPOS技术原理及AccuSizer仪器图
技术优势:
1.检测范围广,0.15-5000μm;
2.512数据通道;
3.32自定义通道;
4.超高分辨率;
5.微量进样(选配);
6.自动进样(选配);
7.兼容水相和有机相;
8.模块化设计,便于产品升级;
9.传感器现场校准,不需要返;。
内置ISO,USP等系统标准,且可自定义标准;